- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:35.
- Zuletzt bearbeitet 2025-06-01 07:36.
Der Hauptunterschied zwischen Alpha- und Beta-Helix beruht auf der Art der Wasserstoffbindung, die sie bei der Entwicklung dieser Strukturen bilden. Alpha-Helices bilden intramolekulare Wasserstoffbrücken, während die Beta-Helices intermolekulare Wasserstoffbrücken bilden.
Komplexe Proteine haben vier strukturelle Organisationsebenen - primär, sekundär, tertiär und quartär. Die Sekundärstrukturen von Proteinen bilden die Peptidketten in unterschiedlichen Orientierungen. Die Peptidketten bestehen aus Aminosäuresequenzen, die durch Peptidbindungen verbunden sind. Daher gibt es in Proteinen zwei Hauptsekundärstrukturen als Alpha-Helix und Beta-Helix. Darüber hinaus gibt es andere Sekundärstrukturen, die als Beta-Turn- und Hairpin-Strukturen bezeichnet werden. Dieser Artikel konzentriert sich hauptsächlich auf den Unterschied zwischen Alpha- und Beta-Helix.
Was ist Alpha-Helix?
Proteine haben vier strukturelle Organisationsebenen. Von diesen ist die Alpha-Helix die häufigste Sekundärstruktur von Proteinen. Und diese Struktur erscheint als Stab, der um eine zentrale Achse gewunden ist. Außerdem ist die Alpha-Helix eine rechtsgängige Helix. Es könnten jedoch auch linksgängige Helices vorhanden sein. Dabei bilden sich die Peptidbindungen vom Amino- zum Carboxy-Terminus. Aminosäuren verbinden sich über diese Peptidbindungen miteinander. Intramolekulare Wasserstoffbrückenbindungen sind die Hauptursache für die Bildung der Alpha-Helix.
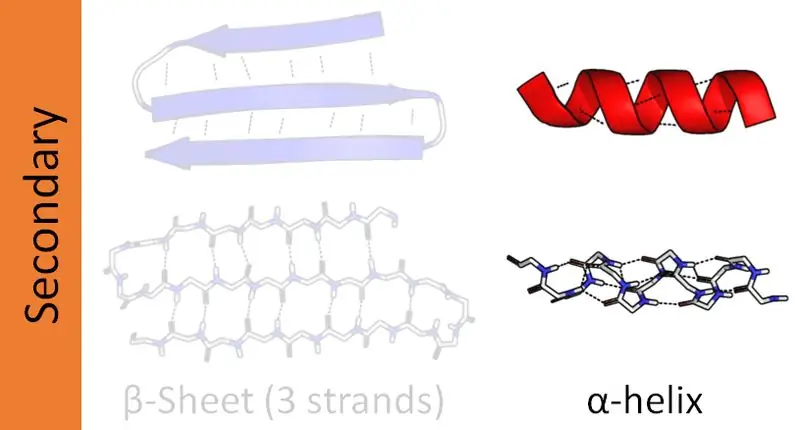
Abbildung 01: Alpha-Helix
Die Anordnung der Alpha-Helix hängt von der hydrophilen und hydrophoben Natur des Proteins ab. Besteht die Aminosäuresequenz aus einer hohen Anzahl hydrophiler R(variable)-Gruppen, orientieren sich die R-Gruppen zur wässrigen Phase. Wenn die variablen Gruppen hydrophob sind, ragen sie in die hydrophobe Phase der Umgebung hinaus. In jedem Szenario scheinen sich die R-Gruppen aus der helikalen Struktur heraus zu erstrecken. Aufgrund dieser strukturellen Eigenschaften ist Alpha-Helix resistenter gegen Mutationen. Somit stabilisiert das Vorhandensein von Wasserstoffbrückenbindungen die Struktur der Alpha-Helix. Es gibt durchschnittlich 3,6 Reste pro Windung in einer Alpha-Helix, da 3,6 Reste für die Entwicklung der Wasserstoffbrückenbindungen benötigt werden. Einige Strukturproteine wie Kollagen und Keratin sind reich an Alpha-Helices.
Was ist Beta-Helix?
Eine Beta-Helix ist die zweithäufigste Sekundärstruktur eines Proteins. Obwohl es nicht so häufig vorkommt wie die Alpha-Helix, spielt das Vorhandensein von Beta-Helices auch eine wichtige Rolle in der Proteinstruktur. Die Bildung der Beta-Helix erfolgt über zwei entweder parallel oder antiparallel angeordnete Beta-F altblätter. Diese Blätter bilden dann eine spiralförmige Struktur. Intermolekulare Wasserstoffbrückenbindungen zwischen zwei Blattsträngen unterstützen die Bildung einer Beta-Helix.

Abbildung 02: Beta-Helix
Beta-Helices können je nach Bindungsmuster sowohl rechtshändig als auch linkshändig sein. Bei der Bildung einer Beta-Helix ordnen sich die variablen Gruppen der beiden Beta-F altblätter innerhalb des Kerns der Helix an. Daher hat die Mehrheit der Gruppen, die Beta-F altblätter bilden, hydrophobe Funktionen.
Im Gegensatz zur Alpha-Helix bilden bei Beta-Helices 17 Reste eine Windung. Metallionen haben die Fähigkeit, die Bildung von Beta-Helix zu aktivieren. Ähnlich wie bei der Alpha-Helix unterstützen die Wasserstoffbrückenbindungen die Aufrechterh altung der Struktur der Beta-Helix. Carboanhydrase-Enzym und Pektatlyase sind zwei Proteine, die reich an Beta-Helices sind.
Was sind die Ähnlichkeiten zwischen Alpha- und Beta-Helix?
- Alpha- und Beta-Helix sind zwei Sekundärstrukturen von Proteinen.
- Aminosäuren sind die Monomere beider Sekundärstrukturen.
- Darüber hinaus sind die chemischen Bestandteile der Alpha- und Beta-Helices Kohlenstoff, Wasserstoff, Sauerstoff, Stickstoff und Schwefel.
- Außerdem entwickeln sich beide sekundären Strukturen zu einer übergeordneten Organisation.
- Außerdem werden beide durch Wasserstoffbrückenbindungen stabilisiert.
- In beiden Strukturen wird die Hydrophobie durch die Anwesenheit der R-Gruppen der Aminosäuren bestimmt.
Was ist der Unterschied zwischen Alpha- und Beta-Helix?
Der Hauptunterschied zwischen der Alpha- und der Beta-Helix ist die Art der Wasserstoffbindung, die sie zeigen. Die Alpha-Helix zeigt eine intramolekulare Wasserstoffbindung, während die Beta-Helix eine intermolekulare Wasserstoffbindung zeigt. Außerdem bildet die Alpha-Helix eine rechtsgängige Helix, während die Beta-Helix sowohl rechtsgängige als auch linksgängige Helices bilden kann. Dies ist also auch ein signifikanter Unterschied zwischen Alpha- und Beta-Helix.
Darüber hinaus besteht ein weiterer Unterschied zwischen Alpha- und Beta-Helix darin, dass die Alpha-Helix-Bildung durch die Verdrillung der Aminosäuresequenz erfolgt, wohingegen bei der Beta-Helix-Bildung die beiden Beta-F altblätter entweder parallel oder antiparallel aneinander gebunden sind bilden die helikale Struktur.
Die folgende Infografik enthält weitere Informationen zum Unterschied zwischen Alpha- und Beta-Helix.

Zusammenfassung - Alpha vs. Beta Helix
Sowohl Alpha-Helices als auch Beta-Helices sind wichtig, um komplexe Proteinstrukturen zu identifizieren und abzuleiten. Beide Typen sind Sekundärstrukturen von Proteinen. Alpha-Helix ist jedoch eine helikale Verdrehung von Aminosäuresequenzen. Im Gegensatz dazu erfolgt die Bildung der Beta-Helix über die Wasserstoffbindung von parallelen oder antiparallelen Beta-F altblättern. Darüber hinaus ist die Wasserstoffbindung intramolekular in Alpha-Helix-Form, während die Wasserstoffbindung intermolekular in Beta-Helix-Form ist. Außerdem haben diese beiden Strukturen eine R-Gruppe, die die Hydrophobizität des Proteins bestimmt. Somit fasst dies den Unterschied zwischen Alpha- und Beta-Helix zusammen.






