- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:35.
- Zuletzt bearbeitet 2025-06-01 07:36.
Der Hauptunterschied zwischen Reaktionen erster und zweiter Ordnung besteht darin, dass die Geschwindigkeit von Reaktionen erster Ordnung von der ersten Potenz der Reaktantenkonzentration in der Geschwindigkeitsgleichung abhängt, während die Geschwindigkeit von Reaktionen zweiter Ordnung von der zweiten Potenz der Konzentration abhängt Term in der Ratengleichung.
Die Ordnung einer Reaktion ist die Summe der Potenzen, mit denen die Reaktantenkonzentrationen in der Geschwindigkeitsgesetzgleichung angehoben werden. Gemäß dieser Definition gibt es mehrere Reaktionsformen; Reaktionen nullter Ordnung (diese Reaktionen hängen nicht von der Konzentration der Reaktanten ab), Reaktionen erster Ordnung und Reaktionen zweiter Ordnung.
Was sind Reaktionen erster Ordnung?
Reaktionen erster Ordnung sind chemische Reaktionen, deren Reaktionsgeschwindigkeit von der molaren Konzentration eines der an der Reaktion beteiligten Reaktanten abhängt. Daher ist gemäß der obigen Definition für die Reaktionsordnung die Summe der Potenzen, mit denen die Reaktantenkonzentrationen in der Geschwindigkeitsgesetzgleichung erhöht werden, immer 1. Es kann entweder ein einzelner Reaktant vorhanden sein, der an diesen Reaktionen teilnimmt. Dann bestimmt die Konzentration dieses Reaktanten die Geschwindigkeit der Reaktion. Aber manchmal gibt es mehr als einen Reaktanten, der an diesen Reaktionen teilnimmt, dann bestimmt einer dieser Reaktanten die Geschwindigkeit der Reaktion.
Betrachten wir ein Beispiel, um dieses Konzept zu verstehen. Bei der Zersetzungsreaktion von N2O5 bildet es NO2 und O 2 Gase als Produkte. Da es nur einen Reaktanten hat, können wir die Reaktion und die Geschwindigkeitsgleichung wie folgt schreiben.
2N2O5(g) → 4NO2(g) + O 2(g)
Rate=k[N2O5(g)]m
Hier ist k die Geschwindigkeitskonstante dieser Reaktion und m die Reaktionsordnung. Daher ist nach experimentellen Bestimmungen der Wert von m 1. Somit ist dies eine Reaktion erster Ordnung.
Was sind Reaktionen zweiter Ordnung?
Reaktionen zweiter Ordnung sind chemische Reaktionen, deren Reaktionsgeschwindigkeit von der molaren Konzentration von zwei der Reaktanten oder der zweiten Potenz eines an der Reaktion beteiligten Reaktanten abhängt. Daher ist gemäß der obigen Definition für die Reaktionsordnung die Summe der Potenzen, mit denen die Reaktantenkonzentrationen in der Geschwindigkeitsgesetzgleichung erhöht werden, immer 2. Wenn es zwei Reaktanten gibt, hängt die Reaktionsgeschwindigkeit von der ersten Potenz ab der Konzentration jedes Reaktanten.
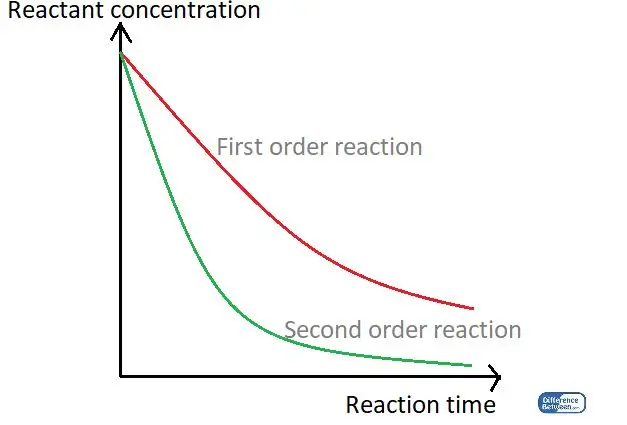
Abbildung 01: Ein Diagramm, das die beiden Reaktionsreihenfolgen anhand ihrer Reaktionszeit und der Reaktantenkonzentration vergleicht.
Wenn wir die Konzentration eines Reaktanten um das 2-fache erhöhen (wenn es zwei Reaktanten in der Geschwindigkeitsgleichung gibt), dann erhöht sich die Reaktionsgeschwindigkeit um das 4-fache. Betrachten wir zum Beispiel die folgende Reaktion.
2A → P
Hier ist A ein Reaktant und P das Produkt. Wenn es sich um eine Reaktion zweiter Ordnung handelt, lautet die Geschwindigkeitsgleichung für diese Reaktion wie folgt.
Rate=k[A]2
Aber für eine Reaktion mit zwei verschiedenen Reaktanten wie folgt;
A + B → P
Rate=k[A]1[B]1
Was ist der Unterschied zwischen Reaktionen erster und zweiter Ordnung?
Reaktionen erster Ordnung sind chemische Reaktionen, deren Reaktionsgeschwindigkeit von der molaren Konzentration eines der an der Reaktion beteiligten Reaktanten abhängt. Wenn wir also die Konzentration des Reaktanten um das Zweifache erhöhen, erhöht sich die Reaktionsgeschwindigkeit um das Zweifache. Reaktionen zweiter Ordnung sind chemische Reaktionen, deren Reaktionsgeschwindigkeit von der molaren Konzentration von zwei der Reaktanten oder der zweiten Potenz eines an der Reaktion beteiligten Reaktanten abhängt. Wenn wir also die Konzentration des Reaktanten um das Zweifache erhöhen, erhöht sich die Reaktionsgeschwindigkeit um das Vierfache. Die folgende Infografik zeigt den Unterschied zwischen Reaktionen erster und zweiter Ordnung in tabellarischer Form.

Zusammenfassung - Reaktionen erster und zweiter Ordnung
Es gibt drei Haupttypen von Reaktionen entsprechend der Reihenfolge der Reaktion; Reaktionen nullter Ordnung, erster Ordnung und zweiter Ordnung. Der Hauptunterschied zwischen Reaktionen erster und zweiter Ordnung besteht darin, dass die Geschwindigkeit einer Reaktion erster Ordnung von der ersten Potenz der Reaktantenkonzentration in der Geschwindigkeitsgleichung abhängt, während die Geschwindigkeit einer Reaktion zweiter Ordnung von der zweiten Potenz des Konzentrationsterms in der Gleichung abhängt Ratengleichung.






