- Autor Alex Aldridge aldridge@what-difference.com.
- Public 2023-12-17 13:35.
- Zuletzt bearbeitet 2025-06-01 07:36.
Hauptunterschied - starker Ligand vs. schwacher Ligand
Ein Ligand ist ein Atom, Ion oder ein Molekül, das zwei seiner Elektronen über eine koordinative kovalente Bindung mit einem zentralen Atom oder Ion abgibt oder teilt. Das Konzept der Liganden wird unter Koordinationschemie diskutiert. Liganden sind chemische Spezies, die an der Bildung von Komplexen mit Metallionen beteiligt sind. Sie werden daher auch als Komplexbildner bezeichnet. Liganden können basierend auf der Dentizität des Liganden einzähnig, zweizähnig, dreizähnig usw. sein. Dentizität ist die Anzahl der in einem Liganden vorhandenen Donorgruppen. Einzähnig bedeutet, dass der Ligand nur eine Donorgruppe hat. Bidentat bedeutet, dass es zwei Donorgruppen pro Ligandenmolekül hat. Es gibt zwei Haupttypen von Liganden, die basierend auf der Kristallfeldtheorie kategorisiert werden; starke Liganden (oder starke Feldliganden) und schwache Liganden (oder schwache Feldliganden). Der Hauptunterschied zwischen starken Liganden und schwachen Liganden besteht darin, dass die Aufsp altung von Orbitalen nach der Bindung an einen starken Feldliganden einen höheren Unterschied zwischen den Orbitalen mit höherem und niedrigerem Energieniveau verursacht, während die Aufsp altung von Orbitalen nach der Bindung an einen schwachen Feldliganden einen geringeren Unterschied verursacht zwischen den Orbitalen mit höherem und niedrigerem Energieniveau.
Was ist die Kristallfeldtheorie?
Kristallfeldtheorie kann als ein Modell beschrieben werden, das das Aufbrechen von Entartungen (Elektronenhüllen gleicher Energie) von Elektronenorbitalen (normalerweise d- oder f-Orbitale) aufgrund des von einer Umgebung erzeugten statischen elektrischen Felds erklären soll Anion oder Anionen (oder Liganden). Diese Theorie wird häufig verwendet, um das Verh alten von Übergangsmetallionenkomplexen zu demonstrieren. Diese Theorie kann die magnetischen Eigenschaften, Farben von Koordinationskomplexen, Hydratationsenthalpien usw. erklären.
Theorie:
Die Wechselwirkung zwischen Metallion und Liganden entsteht durch die Anziehung zwischen dem positiv geladenen Metallion und der negativen Ladung der ungepaarten Elektronen des Liganden. Diese Theorie basiert hauptsächlich auf den Änderungen, die in fünf entarteten Elektronenorbitalen auftreten (ein Metallatom hat fünf d-Orbitale). Wenn sich ein Ligand dem Metallion nähert, sind die ungepaarten Elektronen einigen d-Orbitalen näher als denen anderer d-Orbitale des Metallions. Dies verursacht einen Verlust an Entartung. Außerdem stoßen die Elektronen in den d-Orbitalen die Elektronen des Liganden ab (weil beide negativ geladen sind). Daher haben die d-Orbitale, die näher am Liganden liegen, eine höhere Energie als die anderer d-Orbitale. Dies führt zur Aufsp altung von d-Orbitalen in hochenergetische d-Orbitale und niederenergetische d-Orbitale, basierend auf der Energie.
Einige Faktoren, die diese Aufteilung beeinflussen, sind: Natur des Metallions, der Oxidationszustand des Metallions, die Anordnung von Liganden um das zentrale Metallion herum und die Natur von Liganden. Nach der energetischen Aufsp altung dieser d-Orbitale ist der Unterschied zwischen den hoch- und niederenergetischen d-Orbitalen als Kristallfeldaufsp altungsparameter bekannt (∆oct für oktaedrische Komplexe).
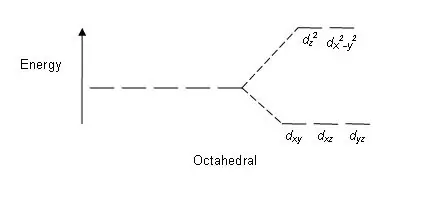
Abbildung 01: Aufsp altungsmuster in oktaedrischen Komplexen
Aufsp altungsmuster: Da es fünf d-Orbitale gibt, erfolgt die Aufsp altung im Verhältnis 2:3. In oktaedrischen Komplexen befinden sich zwei Orbitale auf dem hohen Energieniveau (zusammen als „eg“bezeichnet) und drei Orbitale auf dem niedrigeren Energieniveau (zusammen als t2g bezeichnet). In tetraedrischen Komplexen tritt das Gegenteil auf; drei Orbitale befinden sich auf dem höheren Energieniveau und zwei auf dem niedrigeren Energieniveau.
Was ist ein starker Ligand?
Ein starker Ligand oder ein starker Feldligand ist ein Ligand, der zu einer höheren Kristallfeldaufsp altung führen kann. Das bedeutet, dass die Bindung eines starken Feldliganden einen größeren Unterschied zwischen den Orbitalen mit höherem und niedrigerem Energieniveau verursacht. Beispiele sind CN- (Cyanidliganden), NO2- (Nitroligand) und CO (Carbonyl). Liganden).
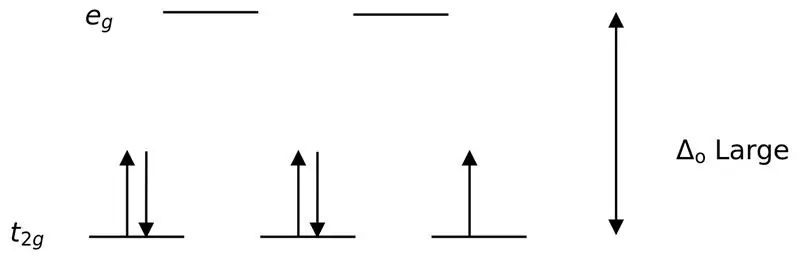
Abbildung 02: Low Spin Splitting
Bei der Bildung von Komplexen mit diesen Liganden werden zunächst die niederenergetischen Orbitale (t2g) vollständig mit Elektronen gefüllt, bevor sie zu anderen Orbitalen mit hohem Energieniveau (z. B.) gefüllt werden. Die so gebildeten Komplexe werden „Low-Spin-Komplexe“genannt.
Was ist ein schwacher Ligand?
Ein schwacher Ligand oder ein schwacher Feldligand ist ein Ligand, der zu einer geringeren Kristallfeldaufsp altung führen kann. Das bedeutet, dass die Bindung eines schwachen Feldliganden einen geringeren Unterschied zwischen den Orbitalen mit höherem und niedrigerem Energieniveau verursacht.
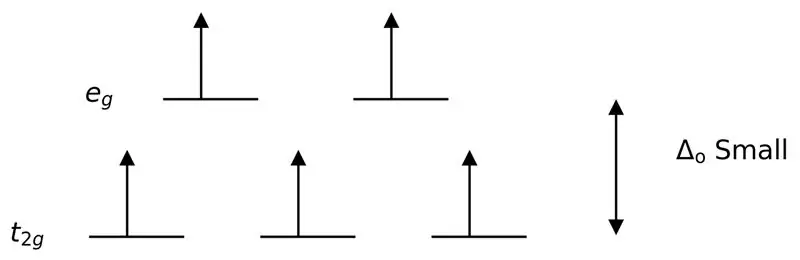
Abbildung 3: High Spin Splitting
In diesem Fall, da der geringe Unterschied zwischen den beiden Orbitalniveaus Abstoßungen zwischen Elektronen in diesen Energieniveaus verursacht, können die Orbitale mit höherer Energie im Vergleich zu denen in Orbitalen mit niedriger Energie leicht mit Elektronen gefüllt werden. Die mit diesen Liganden gebildeten Komplexe werden „High-Spin-Komplexe“genannt. Beispiele für schwache Feldliganden sind I- (Jodidligand), Br- (Bromidligand) usw.
Was ist der Unterschied zwischen starkem Ligand und schwachem Ligand?
Starker Ligand vs. Schwacher Ligand |
|
| Ein starker Ligand oder ein starker Feldligand ist ein Ligand, der zu einer höheren Kristallfeldaufsp altung führen kann. | Ein schwacher Ligand oder ein schwacher Feldligand ist ein Ligand, der zu einer geringeren Kristallfeldaufsp altung führen kann. |
| Theorie | |
| Die Aufsp altung nach Bindung eines starken Feldliganden verursacht einen größeren Unterschied zwischen den Orbitalen mit höherem und niedrigerem Energieniveau. | Die Aufsp altung von Orbitalen nach Bindung eines schwachen Feldliganden verursacht einen geringeren Unterschied zwischen den Orbitalen mit höherem und niedrigerem Energieniveau. |
| Kategorie | |
| Die mit starken Feldliganden gebildeten Komplexe werden „Low-Spin-Komplexe“genannt. | Die mit schwachen Feldliganden gebildeten Komplexe werden „High-Spin-Komplexe“genannt. |
Zusammenfassung - Starker Ligand vs. Schwacher Ligand
Starke Liganden und schwache Liganden sind Anionen oder Moleküle, die eine Aufsp altung der d-Orbitale eines Metallions in zwei Energieniveaus bewirken. Der Unterschied zwischen starken Liganden und schwachen Liganden besteht darin, dass die Aufsp altung nach Bindung eines starken Feldliganden einen höheren Unterschied zwischen den Orbitalen mit höherem und niedrigerem Energieniveau verursacht, während die Aufsp altung von Orbitalen nach Bindung eines schwachen Feldliganden einen geringeren Unterschied zwischen höheren und niedrigeren verursacht Orbitale des Energieniveaus.






