- Autor Alex Aldridge [email protected].
- Public 2023-12-17 13:35.
- Zuletzt bearbeitet 2025-06-01 07:36.
Hauptunterschied - Methan vs. Ethan
Methan und Ethan sind die kleinsten Mitglieder der Familie der Alkane. Die Summenformeln dieser beiden organischen Verbindungen sind CH4 bzw. C2H6. Der Hauptunterschied zwischen Methan und Ethan ist ihre chemische Struktur; Ein Ethanmolekül kann als zwei Methylgruppen angesehen werden, die als Dimer von Methylgruppen verbunden sind. Die anderen chemischen und physikalischen Unterschiede ergeben sich hauptsächlich aus diesem strukturellen Unterschied.
Was ist Methan?
Methan ist das kleinste Mitglied der Alkanfamilie mit der chemischen Formel CH4 (vier Wasserstoffatome sind an ein Kohlenstoffatom gebunden). Es gilt als Hauptbestandteil von Erdgas. Methan ist ein farb-, geruch- und geschmackloses Gas; auch bekannt als Karban, Sumpfgas, Erdgas, Kohlenstofftetrahydrid und Wasserstoffkarbid. Es kann leicht entzündet werden und sein Dampf ist leichter als die Luft.
Methan kommt natürlich unter der Erde und unter dem Meeresboden vor. Das atmosphärische Methan gilt als Treibhausgas. Methan zerfällt in CH3- mit Wasser in der Atmosphäre.
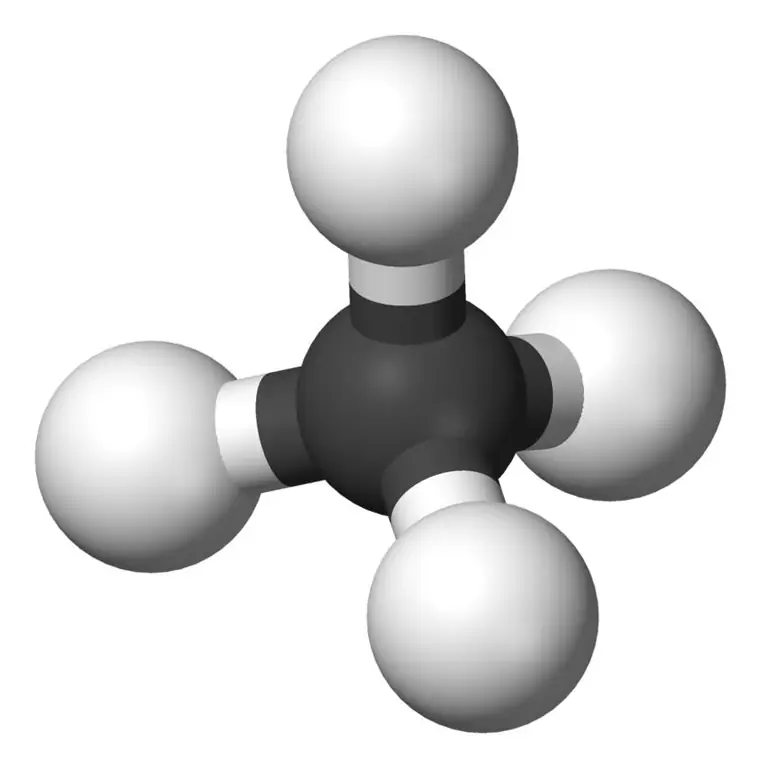
Was ist Ethan?
Ethan ist eine farblose, geruchlose gasförmige Verbindung bei Standardtemperatur und -druck. Seine Summenformel und sein Molekulargewicht sind C2H6 bzw. 30,07 g·mol−1. Es wird aus Erdgas als Nebenprodukt bei der Erdölraffination isoliert. Ethan ist sehr wichtig bei der Ethylenproduktion.
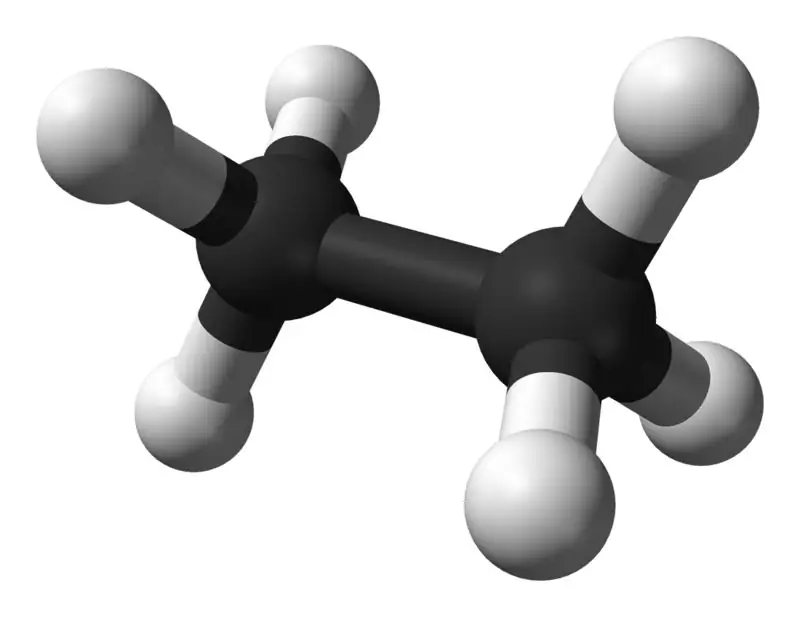
Was ist der Unterschied zwischen Methan und Ethan?
Eigenschaften von Methan und Ethan
Struktur:
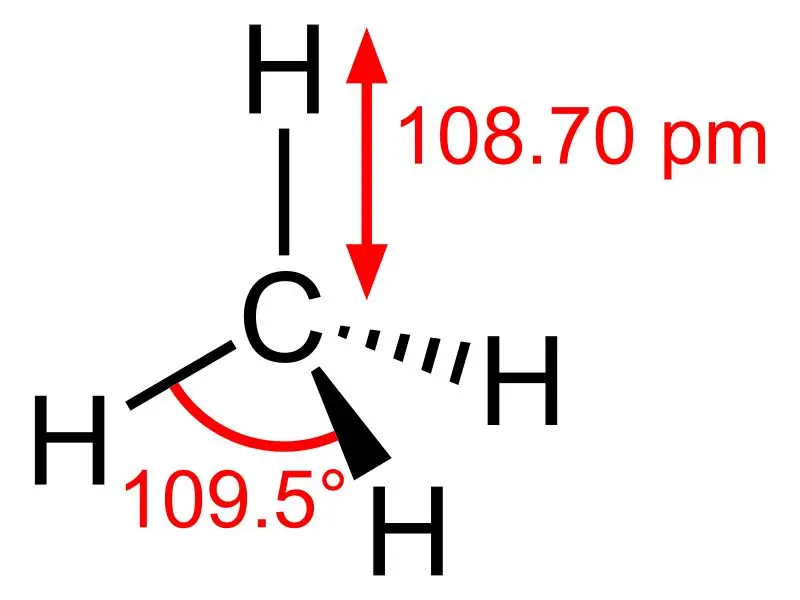
Methan: Die Summenformel von Methan lautet CH4, und ist ein Beispiel für ein tetraedrisches Molekül mit vier äquivalenten CH-Bindungen (Sigma-Bindungen). Der Bindungswinkel zwischen H-C-H-Atomen beträgt 109,50 und alle C-H-Bindungen sind äquivalent und betragen 108,70 pm.
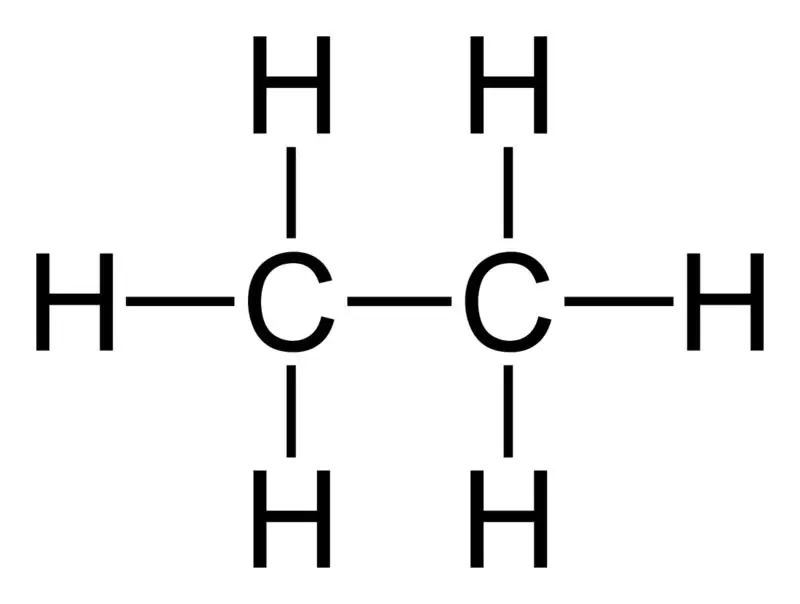
Ethan: Die Summenformel von Ethan ist C2H6,und es ist ein gesättigter Kohlenwasserstoff, da es keine Mehrfachbindungen enthält.
Chemische Eigenschaften:
Methan:
Stabilität: Methan ist ein chemisch sehr stabiles Molekül, das nicht mit KMnO4, K2Cr reagiert 2O7, H2SO4 oder HNO 3 unter normalen Bedingungen.
Verbrennung: In Gegenwart von überschüssiger Luft oder Sauerstoff verbrennt Methan mit einer blassblauen, nicht leuchtenden Flamme, wobei Kohlendioxid und Wasser entstehen. Es ist eine stark exotherme Reaktion; daher wird es als ausgezeichneter Brennstoff verwendet. Bei unzureichender Luft- oder Sauerstoffzufuhr verbrennt es teilweise zu Kohlenmonoxid (CO)-Gas.
Substitutionsreaktionen: Methan zeigt Substitutionsreaktionen mit Halogenen. Bei diesen Reaktionen werden ein oder mehrere Wasserstoffatome durch eine gleiche Anzahl von Halogenatomen ersetzt, was als „Halogenierung“bezeichnet wird.” Es reagiert mit Chlor (Cl) und Brom (Br) in Gegenwart von Sonnenlicht.
Reaktion mit Dampf: Wenn eine Mischung aus Methan und Dampf durch ein erhitztes (1000 K) Nickel auf einer Aluminiumoxidoberfläche geleitet wird, kann es Wasserstoff erzeugen.
Pyrolyse: Wenn Methan auf etwa 1300 K erhitzt wird, zerfällt es zu Ruß und Wasserstoff.
Ethan:
Reaktionen: Ethangas (CH3CH3) reagiert mit Bromdampf in Gegenwart von Licht zu Bromethan, (CH 3CH2Br) und Bromwasserstoff (HBr). Es ist eine Substitutionsreaktion; ein Wasserstoffatom in Ethan wird durch ein Bromatom ersetzt.
CH3CH3 + Br2 à CH3 CH2Br + HBr
Verbrennung: Die vollständige Verbrennung von Ethan erzeugt 1559,7 kJ/mol (51,9 kJ/g) Wärme, Kohlendioxid und Wasser.
2 C2H6 + 7 O2 → 4 CO 2 + 6 H2O + 3120 kJ
Es kann auch ohne Sauerstoffüberschuss auftreten, wobei eine Mischung aus amorphem Kohlenstoff und Kohlenmonoxid entsteht.
2 C2H6 + 3 O2 → 4 C + 6 H 2O + Energie
2 C2H6 + 5 O2 → 4 CO + 6 H 2O + Energie
2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + Energie etc.
Definitionen:
Substitutionsreaktionen: Eine Substitutionsreaktion ist eine chemische Reaktion, bei der eine funktionelle Gruppe in einer chemischen Verbindung verdrängt und durch eine andere funktionelle Gruppe ersetzt wird.
Verwendungen:
Methan: Methan wird in vielen industriellen chemischen Prozessen (als Brennstoff, Erdgas, verflüssigtes Erdgas) verwendet und als gekühlte Flüssigkeit transportiert.
Ethan: Ethan wird als Kraftstoff für Motoren und als Kältemittel für ein System mit extrem niedrigen Temperaturen verwendet. Es wird in Stahlflaschen als verflüssigtes Gas unter seinem eigenen Dampfdruck versandt.






